2012年8月31日,永利yl23411官网登录朱永群教授实验室和北京生命科学研究所邵峰高级研究员实验室合作在Cell杂志上发表题为“Structurally Distinct Bacterial TBC-like GAPs Link Arf GTPase to Rab1 Inactivation to Counteract Host Defenses”的文章。该文章报道了志贺氏痢疾杆菌和肠致病大肠杆菌的效应蛋白分子VirA和EspG采用独特的方式失活宿主的小G蛋白Rab1,阻断Rab1介导的膜泡运输过程,从而有效抑制宿主抗细菌感染防御系统的激活。
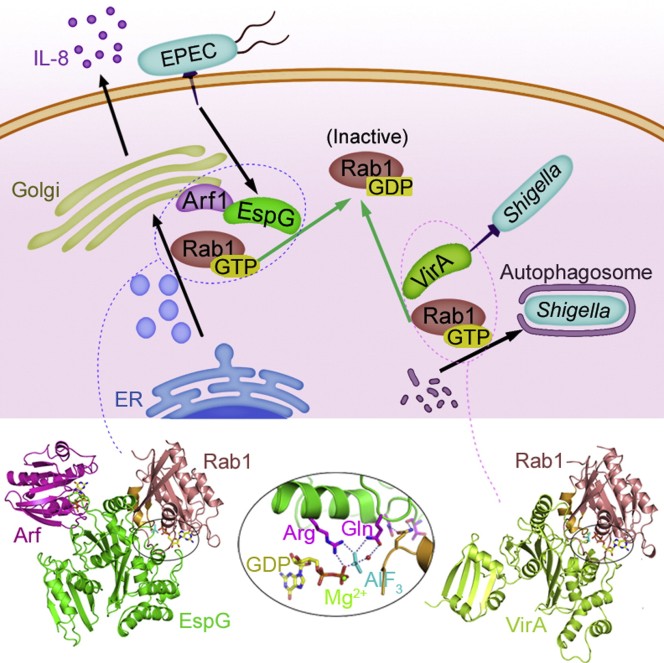
通过三型分泌系统分泌毒力效应蛋白分子进入真核宿主体内,进而阻断或调节宿主抗微生物感染相关的防御信号通路是许多革蓝氏阴性病原菌普遍采用的致病机制。志贺氏痢疾杆菌(Shigella flexneri)和肠致病大肠杆菌(Enteropathogenic E. coli)均为肠道病原菌,感染导致腹泻,前者为侵袭性胞内菌,而后者则在肠上皮细胞外生存和繁殖。早在1995年研究人员就发现痢疾杆菌在宿主细胞内的生存复制依赖于其三型分泌系统分泌的关键效应蛋白VirA。VirA缺失的痢疾杆菌突变体在宿主细胞内生存能力的下降可以被异源表达来自肠致病大肠杆菌的效应蛋白 EspG所弥补。对肠致病大肠杆菌本身来说,EspG只在小鼠感染模型中显示出促进细菌生存的作用。VirA与EspG具有大约20%的序列同源性,提示他们的生物化学活性可能具有一定程度的相似性。然而17年来关于VirA和EspG的宿主靶蛋白分子是什么以及它们的生物学功能机制一直不清楚。
在这项研究中,邵峰博士实验室的研究人员首先巧妙地利用了VirA抑制酵母菌生长的表型,筛查了VirA和EspG中保守的46个氨基酸残基,最终找到185位的天冬氨酸、188位的精胺酸和280位的谷氨酰胺对于VirA抑制酵母菌生长必不可少。他们进一步发现188位的精胺酸甚至不能被性质相近的赖氨酸所替换。这个发现使他们联想到负责催化小G蛋白GTP水解的GAP(GTPase- activating protein)蛋白中的关键精胺酸也具有类似的特性,在这个想法的指导下,他们重新分析了VirA和EspG的序列,发现上述三个关键残基及其周围的序列和作用于Rab家族小G蛋白的TBC样GAP蛋白中的精氨酸和谷氨酰胺“催化双指”活性区域有高度的相似性。在后续一系列生物化学,酶学和细胞生物学的实验中,研究人员不仅发现VirA和EspG具有比宿主TBC样GAP更强的催化活性,而且还筛选和鉴定出Rab1为VirA和EspG最合适的底物和宿主靶蛋白。有意思的是,细菌感染实验结果显示,痢疾杆菌利用VirA对Rab1的特异失活作用来抑制宿主细胞对胞内痢疾杆菌的自噬清除,从而促进该菌的胞内生存。与VirA不同,肠致病大肠杆菌则利用EspG对Rab1的催化失活来阻断内质网到顺式高尔基体的膜泡运输,从而破坏宿主细胞的胞外分泌信号通路。研究人员也确实发现在肠道感染炎症反应中起重要作用的白介素8的分泌会被EspG有效抑制,这也解释了为什么EspG缺失的突变体细菌只在小鼠感染实验中才显示出毒性减弱的表型。
通过和永利yl23411官网登录朱永群教授合作,解析了VirA和EspG分别与Rab1形成的催化中间体复合物的三维晶体结构,发现VirA和EspG结构相似,但采用与真核细胞中的TBC样GAP完全不同的三维折叠模式。深入的结构分析不仅揭示了VirA和EspG识别Rab1的具体分子机制,同时还证明了VirA和EspG活性中心的精氨酸和谷氨酰胺残基采取了与TBC样GAP非常类似的“双指”催化方式。此前曾有报道,EspG可以和小G蛋白Arf1/6相互作用,这项研究也进一步解析了Arf6-EspG-Rab1的三元复合物晶体结构。该结构清晰地展示了EspG分子利用同一侧的两个不同的表面分别结合Arf和Rab1,并且Arf是以活性状态结合在EspG上的,直接说明了EspG是通过和Arf1的特异性结合准确定位到顺式高尔基体相关的膜泡上,进而有效接近并催化Rab1中GTP水解和Rab1失活,以抑制宿主炎症因子的分泌,完美地解释了EspG与VirA以同样的活性作用同样的底物,但具有不同的生物学功能的原因。
这项研究发现痢疾杆菌和肠致病大肠杆菌利用一类具有全新结构模式,但采用和宿主TBC样GAP类似“催化双指”机制的毒力效应蛋白分子,特异性识别并失活宿主小G蛋白Rab1,分别实现对宿主自噬作用和炎症因子分泌所介导的抗感染防御通路的抑制。同时这项研究成果也预示TBC样GAP可能被许多其它病原菌广泛采用来拮抗宿主的防御信号通路,同时也丰富和深入了人们对GAP蛋白结构功能关系的认识。
邵峰博士和朱永群博士为本文共同通讯作者。邵峰实验室的博士后董娜和朱永群博士为本文共同第一作者;朱永群博士完成了本文中的结构生物学部分的主要工作;其他参加该工作的还有邵峰实验室的博士后陆秋鹤、技术员胡丽燕和郑玉清。此项研究中,邵峰博士实验室得到科技部973和美国霍华德-休斯医学研究所的资助,朱永群博士实验室由永利yl23411官网登录启动经费资助。
永利yl23411官网登录
2012年9月1日




