哺乳动物的受精卵在发育到2-4细胞期以后,胚胎自身的基因组才开始具有广泛的转录活性。在这一阶段率先表达出来的基因被称作early zygotic gene,对后续的卵裂球命运决定、发育全能性维持和胚胎植入具有重要调节作用,但是目前对这些early zygotic gene的功能研究还很少。在本研究中,范衡宇课题组发现,一个叫做DCAF13的CRL4 E3泛素连接酶底物识别蛋白在人和小鼠早期胚胎中高表达,属于一个以前从未报道过的early zygotic gene。该基因在进化过程中高度保守,从酵母到人类基因组中都可以找到它的同源基因,但生理功能却未被研究过。因此,课题组制作了Dcaf13基因敲除小鼠,发现缺失DCAF13的胚胎只能发育至桑葚胚阶段,并伴随着8-细胞胚胎阶段的rRNA转录活性减弱、胚胎不能发生致密化,在植入子宫前死亡,说明DCAF13介导的生化过程对于植入前胚胎的存活和发育至关重要。
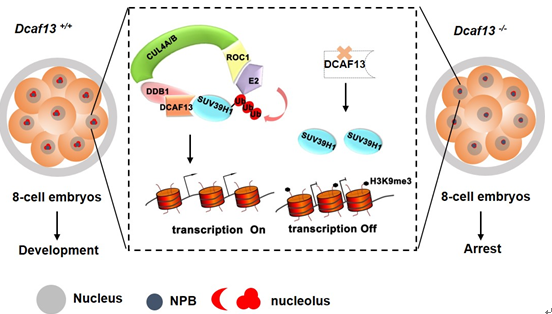
进而,课题组继续深入研究了DCAF13的作用机制。精卵结合启动了程序性的早期胚胎发育过程,并伴随父母双方来源染色质的剧烈重编程。相比体细胞核移植(SCNT)和iPSC的重编程过程,正常受精形成的胚胎发育潜能更高。前期研究显示,SCNT和iPSC过程中组蛋白甲基转移酶SUV39H1是阻碍重编程效率的重要因子。SUV39H1介导特定染色质区域的组蛋白H3第9位赖氨酸发生三甲基化修饰(H3K9me3),从而促进异染色质形成、抑制该区域基因的转录。这种表观遗传修饰的擦除,是胚胎发育激活和体细胞重编程过程的关键限速步骤。那么在早期胚胎的高效重编程过程中,哪些生化机制调控着SUV39H1的稳定和活性,以前尚不清楚。
在本研究中,课题组发现DCAF13与SUV39H1蛋白分子可以相互结合,并在细胞核中共定位。进一步在受精卵中过表达SUV39H1,胚胎能产生类似DCAF13敲除的现象;生化实验证实,DCAF13把SUV39H1招募到CRL4 E3泛素连接酶复合体上,使SUV39H1发生多聚泛素化并被降解,维持8-细胞胚胎阶段的H3K9me3处于低水平,从而促进核糖体DNA和一些早期胚胎胚层分化相关基因的活跃转录。该研究不仅发现了维持早期胚胎发育潜能的新分子,也揭示了早期胚胎高效重编程的内在分子机制。
<span style="font-family:" font-size:12pt;"="">原文链接:http://emboj.embopress.org/content/early/2018/08/14/embj.201898981




