条件性敲除小鼠
定义:
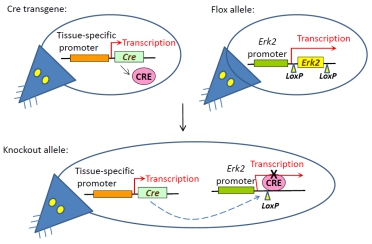
条件性基因敲除小鼠(也叫Flox小鼠)是指在目的基因中含有成对的loxp位点的小鼠,与Cre工具小鼠交配
后可在特定的组织或细胞中敲除目的基因。
l CKO如何实现?
重组酶系统(如:Cre-loxP)介导的位点特异性重组技术。
Cre是重组酶(38kDa),可识别 34bp 长的 DNA 序列loxP。loxP 两侧各 13bp 构成回文结构,中间 8bp
为非回文结构,因此loxp具有方向性。
(当 DNA 分子上存在两个同向 loxP 序列时,Cre可将两个loxP 序列之间的DNA 片段切出并环化,同时
将 loxP 两侧的序列进行连接;当 DNA 分子上存在两个方向相反的 loxP 序列时,Cre 可导致 loxP 之间
的序列发生反转。)
l CKO敲除的是什么?
条件性基因敲除的靶基因中必须带有可以被 Cre 重组酶识别的 loxP 序列,这种基因称为 floxed gene。
带有 floxed 靶基因的小鼠称为 flox 小鼠。在这种小鼠中,通常采用 DNA 同源重组方法,在拟敲除基
因片段的两侧分别放置一个同向的 loxP 位点。
loxP 位点的存在应不影响该基因的功能,故选择对照为flox/flox小鼠
l CKO敲除何时何地发生?
除了 flox 小鼠以外,重组酶系统介导的条件性基因敲除还需要另一类重要的基因工程小鼠的参与——Cre
工具鼠。
Cre 工具鼠中,将 Cre 重组酶的编码序列置于特定的基因启动子下,Cre 的表达特性决定了靶基因何时何
地发生敲除。
Cre 在哪一种组织细胞中表达,靶基因的敲除就发生在哪种组织细胞;Cre 的表达水平将影响靶基因在此
种组织细胞中进行修饰的效率;使用诱导型Cre 重组酶可以通过给予诱导剂,决定在特定的发育时期或
疾病发生阶段,定时地进行基因敲除。
(范衡宇老师课件)
实验时,将 flox 小鼠和 Cre 工具鼠进行交配,最后获得 flox 纯合且 Cre 杂合的小鼠。在这类小鼠中,
凡是表达 Cre 的细胞,两个 loxP 之间的序列被切除,从而实现组织特异性基因敲除。
(参考资料:南方模式生物官网)
l 交配策略
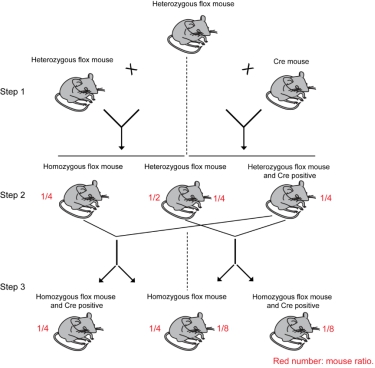
Ø 将获得的flox杂合子小鼠(geneflox/+)分成两部分:
1. flox/+小鼠与Cre小鼠交配,同时获得flox阳性且Cre阳性小鼠(该小鼠简写为:geneflox/+;Cre+),
flox阳性且Cre阴性小鼠(geneflox/+);
2. flox小鼠自交,获得flox纯合(该小鼠简写为:geneflox/flox)和flox杂合小鼠(geneflox/+)。
Ø 为获得flox纯合且Cre阳性的小鼠,可有两种繁育方法选择:
1. 将获得的flox和Cre双阳性杂合子小鼠(geneflox/+:Cre+)与flox杂合子小鼠(geneflox/+)交配,
最终获得flox纯合且Cre阳性的实验组小鼠(该小鼠简写为:geneflox/flox;Cre+,该小鼠所占后代
比例为:1/8)和flox纯合且Cre阴性的对照组小鼠(geneflox/flox,该小鼠所占后代比例为:1/8);
2. 将获得的flox和Cre双阳性杂合子小鼠(geneflox/+:Cre+)与flox纯合子小鼠(geneflox/flox)交配,
最终获得flox纯合且Cre阳性的实验组小鼠(geneflox/flox;Cre+,该小鼠所占后代比例为:1/4)和flox
纯合且Cre阴性的对照组小鼠(geneflox/flox,该小鼠所占后代比例为:1/4)。
Ø 后续实验(实验组:geneflox/flox;Cre+,对照组:实验组:geneflox/flox)
为快速获得上述所需小鼠,可将geneflox/flox;Cre+小鼠与geneflox/flox小鼠杂交
l 小鼠基因型鉴定
Ø 小鼠编号原则

Ø Flox小鼠基因型鉴定(用于鉴定flox纯合、杂合和野生型)
PCR鉴定引物位置示意图(可选择P1,P2引物对,或P3,P4,P1,P4引物对)
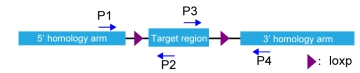
Ø 目的基因组织特异性敲除效果验证
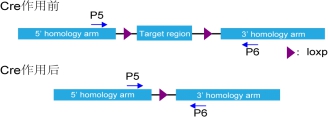
(1) DNA水平cre活性验证
通常是取一小块表达Cre的组织,抽提基因组DNA,通过PCR的方法对flox区域进行扩增,
通过flox区域的有无,定性判断Cre是否发挥作用。
(2) RNA水平cre敲除效率验证
通常是取一小块表达Cre的组织,抽提RNA,反转录成cDNA后,通过Realtime-PCR的方法,
利用Cre作用后的mRNA ,所设计的引物无法扩增出PCR产物的原理,定量判断Cre作用效率。
(3) 蛋白水平cre敲除效率验证
目的组织western blot或免疫组化检测。原理:表达cre的组织无法检测到目的蛋白。
Ø 动物组织DNA抽提
1) 250ul 裂解液+2.5ul proteinase K(10mg/ml) 直接消化组织,放于55℃恒温热浴过夜
2) 加入同体积(250ul)苯酚:氯仿:异戊醇混合物(使用前摇晃瓶身混匀),上下剧烈震荡15s,12000rpm,15min常温离心
3) 转移上清于新的EP管(期间可能会吸起白色絮状物,无妨)
4) 加入等体积的异丙醇,上下剧烈震荡15s,12000rpm,15min常温离心
5) 倒掉上清(也可用真空泵吸,小心底部沉淀),用75%乙醇(400ul),7500rpm, 5min(可多清洗2遍)
6) 将管壁内部及管盖上的残留乙醇吸干,沉淀相对较干,根据不同体积加入ddH2O
注:因没加RNA酶,可能会残余RNA,A260/280会居于1.9以上,但PCR无妨
lysis buffer配制(裂解液):先加水500ml,再加各种成分,最后定容到1L
成分 | 配置(1L) |
1M Tris 8.0-100x | 10mL |
5M Tris 8.0-50x | 20mL |
0.5M EDTA-20x | 50mL |
10% SDS | 50mL |
l 小鼠饲养及繁殖期间遇到的问题
Q:小鼠合笼后,很久都不怀孕?
A:考虑换雌鼠或雄鼠,重新交配
Q:小鼠合笼后,雄鼠和雌鼠比例及年龄选择?
A:雄:雌一般1:2或1:3,不要太多雌鼠。雄鼠至少8w,9-10w更为合适;而雌鼠一般选择6w及以上。
Q:什么时候分笼?
A:大小鼠的哺乳期是20-22d,3周龄可离乳独立生活,因此出生3周后即可将幼鼠与母鼠分开,独立
生活。视小鼠生长情况,可多哺乳几天。有时为避免笼盒中同时存在两胎幼鼠,导致新生的幼鼠被上
一胎幼鼠踩踏致死的情况,在19d左右即可将其分笼。分笼时需要标记新生小鼠,选择减脚趾,或打
耳钉(耳钉一定要订的足够好,否则后续会被小鼠抓掉)
雌鼠4周龄阴腔开张,雄鼠5周龄睾丸降落至阴囊,开始形成精子。因此,4周龄前一定要进行分笼,
以免发生交配
Q:母鼠吃仔怎么办?
A:
1. 雌鼠与雄鼠合笼交配后,雄鼠可以一直与孕鼠一起生活,这样有利于孕鼠整个妊娠过程的稳定
以及仔鼠的出生与哺乳。
2. 怀孕的雌鼠(一般两只)一起生活,或将怀孕及未怀孕的雌鼠在一起。然而,绝对不要在雌鼠
分娩前几天再在笼舍中加入新的雌鼠,这样会打扰到孕鼠以及新生仔鼠;要等仔鼠断奶(21天)
后才能再将雄鼠放入繁殖笼内。
3. 第一胎分娩或太过于年轻的新手母鼠育成仔鼠的成功率比有经验或较为年长的雌鼠要低。仔鼠
出生第一天尽量不要打扰母鼠与幼仔,到第二天母鼠就比较能容忍被打扰的状况了。
4. 若一直持续吃鼠,选择换孕鼠。
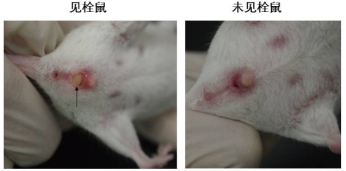
Q:如何准确知道小鼠怀孕天数?
A:傍晚5-6点将雌鼠雄鼠合笼,第二天早晨8点检查雌鼠是否有阴道栓(下图所示)。有阴道栓的
当天中午算为胚胎第0.5天。检栓后,未见到栓的雌雄鼠分开,至下午再进行合笼。不过,观察到
阴道栓只能说明发生了交配行为,并不能完全作为怀孕的标志,见到栓以后仍可能发生未怀孕的情况。
小鼠表型观测参考点:体型差异、毛发、体重、活动能力,最关键还是要结合敲除或敲入基因的具体功能
常见的肝癌模型
1. 诱发性肝癌模型:DEN, DEN+CCl4,HFD+CD+CCl4
2. 移植性肝癌模型:异位移植即皮下成瘤,原位移植(肝脏,经脾脏)
3. 基因敲除鼠(如HBV-TG, PTEN, APC, miR-122肝特异性敲除, Myc肝特异性过表达)
4. 高压尾静脉HTVI
诱发性肝癌模型
Treatment ( Intraperitoneal injection) | Mouse strain | Age | Post-Intrasplenic inoculation (#tumor/# total mice) |
20mg/kg DEN | C57BL-male | 12day | 8month-8.5month |
20mg/kg DEN | C57BL-female | 12day | 9month-10month |
l DEN
l DEN+CCl4
20mg/kg DEN, injected at day 12 of C57BL mice.
1ul/g of 20% of CCL4 (diluted by Olive), start from week 4 of mice, once a week, for 14-18 weeks (Male-16week, female-17week)
移植性肝癌模型
l 皮下成瘤subcutaneous tumor formation
注意点
(1) 肿瘤细胞系选择
(2) 小鼠品系选择:Nude, NOD/SCID, NSG
(3) 接种部位:腋下、腹股沟、侧腹部及颈背部(血管丰富且易操作部位)
操作步骤
(1) 肿瘤细胞的传代扩增
确保肿瘤细胞的活力和良好的生长状态
(病毒感染可选择再传代扩增;若siRNA或质粒转染处理细胞不建议传代扩增,质粒转染24小时,保证
最大效率。siRNA取决于平时做实验的经验。)
(2)计算细胞接种量
结合文献来确定细胞接种量,在找不到相关资料的情况下,最高就用到1000万/0.1ml,不可再高(因为细胞
悬液已达饱和状态)。并且提前计算确定细胞数量,一般注射40只小鼠,至少需要准备50只小鼠的细胞量。
(3)准备裸鼠
一般选择5-6W裸鼠,小于4W动物可能不耐受而过早死亡,大于6W免疫力会增强,不易成瘤;雌雄均可
(4)操作步骤
① 预准备:matrigel 4℃过夜融化,若1人操作可选择使用呼吸麻醉仪,去鼠房前可考虑打一盒冰和带上移
液器和枪头,用注射器不好重悬细胞
② 接种时选择好部位进针,建议接种前酒精棉球擦拭消毒进针位置(实验室选择以后腿股);
③ 向前方穿行,注射前针头稍微动一动,能动说明在皮下,否则可能在皮内或者肌肉内;
④ 针头在皮下走一段再注射,速度不可太快,一般体积为100-200μL(PBS或者无血清培养基稀释细胞,
若不易成瘤可添加matrigel促进成瘤),可看见明显的鼓包;
⑤ 接种点离进针点尽量较远,减少漏液和污染的可能;
⑥ 注射完毕后,缓慢旋转退出针头(Z字型扭),尽量避免漏液;
⑦ 细胞需一直置于冰上,使细胞处于比较低的代谢状态,一般2h之内不会有问题。
(5)后续实验安排
① 分组:一般来说皮下荷瘤主要用于抗肿瘤药物的检测,因此我们一般分为对照组,阳性药物组,
低剂量、中剂量及高剂量药物组等;
② 数量:荷瘤时每组不少于10只,考虑到小鼠成瘤率和死亡原因,最终实验应至少可以获取6个有效数据;
③ 给药时间:一般接种7-10天后便可看到肿瘤长起,便可分组实验(鼠源细胞系会更快);
④ 人道终点:动物伦理学规定,小鼠肿瘤重量不可超过小鼠体重10%,平均肿瘤直径不超过20mm,
并且如果出现溃烂,造成感染或坏死时,应该中止实验且对动物施行安乐死。
(参考资料:http://www.bioraylab.com/knowinfo/17.html)
参考剂量和处理时间
Cell line | Mouse strain | Age | HCC formation |
Huh7 cell (106/flank,100ul PBS+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | 18day(first), 25day (almost) |
Huh7 cell (106/flank,100ul DMEM+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | 14day(first), 20day (almost) |
HLE cell (5*106/flank,100ul PBS+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | × |
Huh7 cell (8*105/flank,100ul PBS+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | 14day(first) |
RBE cell (8*105/flank,100ul PBS+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | 14day(first) |
HUCCT1 cell (8*105/flank,100ul PBS+ 100ul matrigel ) | BALB/c nude mice (Male) | 5w | 14day(first) |
Huh7 cell EpCAM+(Top8%) (5*104/flank,100ul DMEM+ 100ul matrigel ) | Nod SCID (Male) | 5w | 20day(first), 25day (almost) |
Huh7 cell CD133+(Top8%) (5*104/flank,100ul DMEM+ 100ul matrigel ) | Nod SCID (Male) | 5w | 15day(first), 20day (almost) |
l 经脾脏注射肝癌细胞Intrasplenic inoculation
操作步骤:
预准备:麻醉剂2%戊巴比妥钠配置(100ml 0.9%的生理盐水中含有2g戊巴比妥钠,用0.22um 过滤器除菌)。
加热垫、止血钳、prolene线
1.腹腔注射麻醉剂(剂量、/kg,如小鼠体重20g,注射100ul))
2.将麻醉状态的小鼠侧躺(我们的左侧),有毛的老鼠需剃毛。在前肢与后肢中线靠后肢1/3处,用75%酒
精棉擦拭,观察到暗色的脾脏。
3.左手用弯头镊提起皮肤,右手操作眼科剪(弯头朝内)剪开小鼠的皮肤,再用镊子提起皮肤下的肌肉
组织,剪开,此时观察到鲜红色的脾脏,用镊子轻轻将脾脏提出,靠近下缘2mm位置,针面朝上,慢慢
推入的已备好剂量的细胞,可见脾脏被膜肿胀,颜色变稍白。
4.脾脏下缘和上缘各有一条血管,中间无组织粘连,此时左手用镊子夹住这个没有血管和组织的脾脏,
轻轻提起,能明显观察到血管,然后用电凝笔,靠近脾脏将连接的血管和有些许胰腺功能的组织切割
下来,观察切割下来的组织血管是否出血(最好用电凝笔再止血)当电凝笔不能止血时,立刻用止血
钳夹住出血位置,在贴近止血钳下方用缝合线结扎止血(剪线时留,小于2mm线头)。用镊子轻轻将
脾脏稍微往外拉出,观察到上缘的血管,同下缘脾脏血管操作。
5.用镊子提起肌肉组织,此时胰腺较容易重回腹腔。左手用镊子夹住肌肉和皮肤,右手拿缝合针(用离
持针器前2mm位置夹住缝合针)穿过一侧皮肤和肌肉,在将另一侧的肌肉和皮肉夹起,缝合针穿透时,
打开持针器,左手的镊子顺着针的弧度将针拔出(右手的持针器可辅助稳定老鼠)。靠左4-0#丝线绕靠
右的持针器一圈,持针器夹住另一端线头,打结。同操作打第二个结,剪线。用浸有生理盐水的棉花,
擦拭伤口周围血渍。
6.将小鼠趴卧,再用拇指和食指捏住小鼠颈部皮肤,并轻提,右手持注射器将针头插到皮下,注射1ml
生理盐水(防止脱水)。如果注射后出现皮肤起包,则注射到了皮内。(一般情况下,两个手指可以
感觉到针头的位置,可以确定针头是否在皮下)。
7.将脾脏注射后的小鼠放置在加温垫的鼠盒上,以维持其体温。
8.注射后第二天观察小鼠的行为活动,生命体征。
(参考资料:妮娅师姐整理)
Cell line
| BALB/c nude mice | Post-Intrasplenic inoculation (#tumor/# total mice) |
Huh7-ctrl, miR192KO cell (106) | Male-4w | 8w (6/12 outside of liver, 2/12 intra-hepatic) |
l 肝脏原位注射肝癌细胞Intrahepatic transplantation
操作步骤
(1)用50%基质胶重悬细胞,小鼠(选用Nude mice)106个/20-30ul PBS体系
(2)麻醉小鼠:戊巴比妥钠,麻醉后绑定(可用医用胶布)
(3)剃毛后沿腹中线切开皮肤,长度3cm左右,露出剑状软骨,将切口撑开
(4)先用棉签使用生理盐水浸润,然后将肝左叶(最大的一叶)用棉签挑起
(5)缓慢注射20ul细胞悬液,注射后停留5s,旋转退出针头,避免细胞回流。注射成功后在肝脏部
位一般能看见白色突起
(6)注射完毕后消毒腹腔,然后缝合伤口
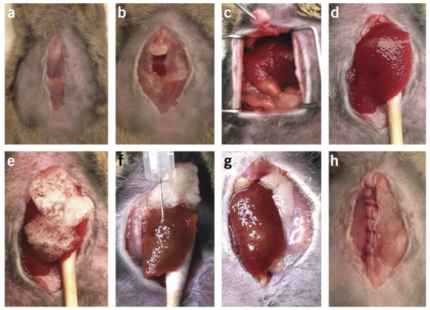
(参考资料:Nat Protoc. 2015 Aug;10(8):1264-74.)
参考剂量:
Cell line
| C57BL | Post-Intrasplenic inoculation (#tumor/# total mice) |
Huh7-ctrl, miR192KO cell (106cell/30ul PBS) | Male-4w | 1month 无肉眼可见结节 |
高压尾静脉HTVI
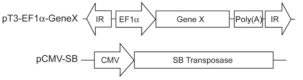
l Sleeping beauty system
注意点
(1) Plasmid of SB: plasmid of gene X=1:10 ~1:25
(2) Time for injection: 5-9 seconds
(3) Buffer: salin (10% mice body weight)
(4) 选用小鼠最好一批出生,要设置的对照和实验组同一天注射
操作步骤
预准备:所用溶剂可为生理盐水或Ringer’s buffer(1L溶液中含0.42g KCl, 9.00g NaCl, 0.24g CaCl2,0.2g NaHCO3)
1. 将小鼠固定,用呼吸麻醉仪持续让小鼠吸入异氟烷
2. 用热水浸湿纸巾捂热小鼠尾巴,使静脉扩张,紧靠白色尾骨两侧有清晰可见的2根红色静脉
3. 用左手的食指、中指、无名指及大拇指将小鼠尾巴固定。手法:握住1ml注射器前面0.1mL处,右
手小指搭在拽着鼠尾的左手拇指处,按此手形进针
4. 注射时左手扯尾,使尾巴紧贴桌面,一般选择距尾尖1/4或1/3处进针,此处皮肤较薄,血管清晰,
进针容易。将欲注射的鼠尾用左手紧紧压在桌面上,右手进针时针头与桌面平行,针尖稍稍朝下,一
旦进入,将针头稍稍上挑进入,针头沿血管进入,肉眼可观察到针头前进。如果针头在血管中前进,
可明显地感觉到针行通畅,毫无阻力。若针头不在血管中,手感针行有阻力。进针时不要太深,针头
入皮肤后马上把针头略往上,平行进针,针扎入时有落空感,推液时无阻力则说明成功了。如果推液
阻力较大,甚至注射处出现渗液,则说明不在静脉内,需要重新调整注射。
5. 注射结束后,用医用棉花止血。可能会出现小鼠心跳骤停,采用挤按心脏部位复苏,密切观察。
注射成功特点:注射到静脉的推液几乎没有阻力,可快速将液体推完。如果注射到静脉以外,强行
推液,阻力较大,注射处周围会出现露水样渗液,而且出针后,出血较少。并且由于药液瘀阻在尾
部,导致血流不畅,尾部缺血,易导致尾部炎症和坏死。
参考剂量
Gene X
| C57BL mouse Ages | plasmid | Post-injection (#tumor/# total mice) |
c-myc | Male-4w | 20ug c-Myc/pT3EF1a + 2ug SB in 1.5mL | 8w (1/6), 12w (1/8) |
cmyc+ MCLI | Male-7w | 2ugMyc/pT3EF1a+2ugMCLI/pT3EF1a+0.3ug SB | 8w (no nodule) |
NRasV12+myr-AKT | Male-4w | 5ug Ras/pT3EF1a +5ug Akt/pT3EF1a +0.67ug SB in 1.5mL | 5w (5/5) |
NRasV12+myr-AKT | Male-6w | 1.5ug Ras/pT3EF1a +1.5ug Akt/pT3EF1a +0.2ug SB in 2mL | 8w (small nodule) |
Gene X
| FVB/N mouse Ages | plasmid | Post-injection (#tumor/# total mice) |
c-myc | Male-4w | 20ug c-Myc/pT3EF1a + 2ug SB in 1.5mL | 8w (1/6), 12w (1/8) |
NRasV12+myr-AKT | Male-4w | 5ug Ras/pT3EF1a +5ug Akt/pT3EF1a +0.67ug SB in 1.5mL | 5w (5/5) |
实验室内部交流问题和解答
1. 当 DNA 分子上存在两个方向相反的 loxP 序列时,Cre 可导致 loxP 之间的序列发生反转,那么序列反转的后果是什么呢?如果是让这段序列失去功能的话,也相当于敲除吗?
解答:序列反转指的是目标序列的倒位,的确失去功能,但应该不算敲除,因为那一段不知道会发生什么作用。
2. 两个loxp之间基因的大小如果会影响敲除效率,那么基因大小的可能极限是?
解答:现已发现两个因素会影响Cre-lox重组的效率。第一个因素是lox序列中不对称区段的碱基序列。第二个影响因素是一对lox序列之间floxed序列的长度,Cre-lox重组的效率随着其长度的增大而降低,或许是因为反应动力学的影响。根据这篇文献,(PLoS One. 2009; 4(1): e4200)建议最长为13kb。
且Cre重组酶在不同物种或者同一物种的不同类型细胞或组织中介导lox位点发生重组的效率差异较大, 目前对导致这种现象产生的内在机理不清楚, 有文献推测这可能是由于Cre重组酶对处于不同类型细胞和不同发育时期的染色质中lox位点的识别能力不同所致。
(参考资料:维基百科)
3. Cre鼠不能鉴定纯合杂合的原因?
解答:判断小鼠是否为cre,用PCR判断只能说有这个酶,有可能是cre+/+,cre+/-,然后用同为cre阳性的2个鼠去杂交,如果后代一直稳定为cre,则上述2只大概率为cre+/+。
4. Cre酶可以发挥效应去切割loxp的是吗?然后切割完loxp两侧的序列还是连接上的吗?
解答:Cre 酶作用后,切除部分为两个同向Loxp位点中间的部分和其中一个Loxp位点,在DNA酶的作用下发生环化,剩下部分相连。
5. 当两个loxp位点方向相同的时候Cre可将两个loxP 序列之间的DNA 片段切出并环化,那环化的这个片段会对小鼠有影响吗?
解答:留下那段环化的loxp序列,因为体内有DNA酶,不受保护,会被降解掉,对体内不会有太大影响。
6. 如果需要检cre的敲除效果,一般取的是什么组织呢?能和基因型鉴定一样用鼠尾吗?
解答:检测Cre的敲检效率需使用条件性敲除的脏器组织(如我们实验室使用的是肝脏)。一般在最初建立品系时会检测一次,从蛋白和RNA的水平(如果是miRNA只能是RNA水平),确定确实已经敲除。在完成实验小鼠死亡后,再次取肝脏组织鉴定敲除效率。如果是全身性敲除的话,鼠尾鉴定是可以从基因组上看出来的,那一段是缺失的。
7. 亲本可用Cre,loxp纯阳性替代吗?
解答:cre是杂合或纯和都会显示cre阳性,而loxp最早公司提供给你的就是loxp+/-,等后续拿到纯和,需要大批量实验组的时候,可以采取均纯阳性。但推荐有杂合的继续进行繁殖。
8. 鼠尾基因型鉴定一般进行几次?
解答:鼠尾基因型鉴定一般在小鼠分笼时和小鼠死亡后各做一次。
9. 实验室所用NASH的模型
解答:DEN+HFCD,12天DEN 20mg/kg, HFCD三周开始喂食,27周有小结节形成。
10. 如果是质粒或siRNA处理细胞去做皮下成瘤,一般细胞处理多久呢?会取一部分再做个鉴定吗,比如有没有过表达或者敲减?
解答:留一部分细胞做检验,质粒转染24小时,保证最大效率。siRNA取决于平时做实验的经验,若24h有效果即可收细胞皮下注射。病毒加足够量确保过表达或敲减,可以再细胞传代的。
11. 选择皮下成瘤的细胞系?
解答:常见有HepG2\SMMC-7721\Huh7\Hep3B\HCCLM3。不推荐HepG2,需要剂量太大且细胞堆叠生长。
12. 皮下注射、肝脏原位注射、脾脏注射产生的肿瘤有什么区别?该怎样判断应该选择哪一种注射方式进行实验?
解答:皮下成瘤的优点:成瘤率高,周期短,肿瘤的大小和位置较易控制,个体差异小,另外,对宿主的影响类似,易于客观判断疗效。缺点:缺乏肿瘤微环境的影响,该模型不能很准确模拟肿瘤细胞在体内生长。
原位移植(经脾脏或肝脏原位注射)的优点:原位生长能更好的模拟肿瘤细胞在体内生长的微环境,药物疗效预测更加精准。缺点:外科移植手术程序复杂且价格昂贵,另外,难于快速检测肿瘤生长及其对药物的反应。
13. 体外成瘤和体内成瘤的细胞系有特殊明显的差异吗?对体内或者皮下成瘤的小鼠在细胞系的选择上有什么要求?
解答:关于皮下成瘤,反应细胞恶性表型主要是增殖和干性,HLE不成瘤很大一个原因是它悬浮小球能力就不好,无法聚成块。原位注射主要反应这个细胞在某种微环境中汲取营养和自我适应的能力。这些都需要考虑细胞系在体外实验中如增殖、转移等能力。
14. 高压尾静脉注射的话,其他脏器会收到影响吗?
解答:根据高压尾静脉的原理,快速将大体积的溶液注射入小鼠尾静脉导致注射溶液在下腔静脉的大量积累,而心脏在短时间内是无法将如此大量的溶液从静脉运输到动脉完成循环的。所以,在下腔静脉就产生了一个很高的静脉压力,从而使肝门静脉的血液倒流,注射的溶液也随即流入肝门静脉。由于肝脏中的血管与肝门静脉相连,注射的溶液于是流入肝脏中且压力很大,迫使肝循环中的血液倒流至毛细血管出口(和微静脉之间)。由于高压的结果,肝窦的孔径增大,肝细胞产生穿孔,膜通透性增加,所以外源大分子就被被压入肝细胞。再过一段时间,细胞膜重新闭合,于是外源大分子就保留在肝细胞,一部分还会进入细胞核。如果转染真核表达质粒,可在其中瞬时表达。可用于转染的大分子有质粒DNA、寡聚核苷酸人工染色体、mRNA、tRNA、rRNA、siRNA、病毒RNA、蛋白等。
上述可看出主要影响肝脏,但也有文献表明对心脏、肾脏、脾脏均有影响,但不及对肝脏影响的0.1%。
15. 高压尾静脉注射实验中,麻醉小鼠后对鼠尾进行高温处理,使静脉扩张,便于观察和注射。可使用呼吸麻醉仪进行实验。高压尾静脉使用的质粒系统为Sleeping beauty,如想扩增某基因/RNA等,将片段构建于pT3-EF1α质粒上,按比例搭配注射。
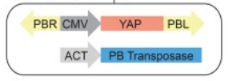
16. 高压尾静脉模型的转座子选择是pb还是sb有区别吗?是鼠对这个系统有差异还是它们有效率差异?
解答:可根据实验需要,选择合适模型。
相同点:Sleeping Beauty(SB)和PiggyBac(PB)
均为转座子,两者均需要转座酶合成基因+能够被转座酶识别的具有反向重复序列的转座元件。
两者转座机制均为剪切、粘贴的DNA转座模式
不同点:
PiggyBac(PB) | Sleeping Beauty(SB) |
PB比SB有更高转座效率 | SB更容易插入到供体附近,具有近距离转座的偏好性 |
SB转座后会留下CAG的3个bp足迹,而PB转座后供体位置不会留下任何序列改变 |
|
|
|
常用为ICR小鼠 | 常用为FVB/N小鼠 |
癌基因如YAP-5SA active mutant注射,需3-4个月成瘤;但2种及以上质粒混打成瘤加快但至少2个月。 | 根据上文总结,一般成瘤小于2个月 |