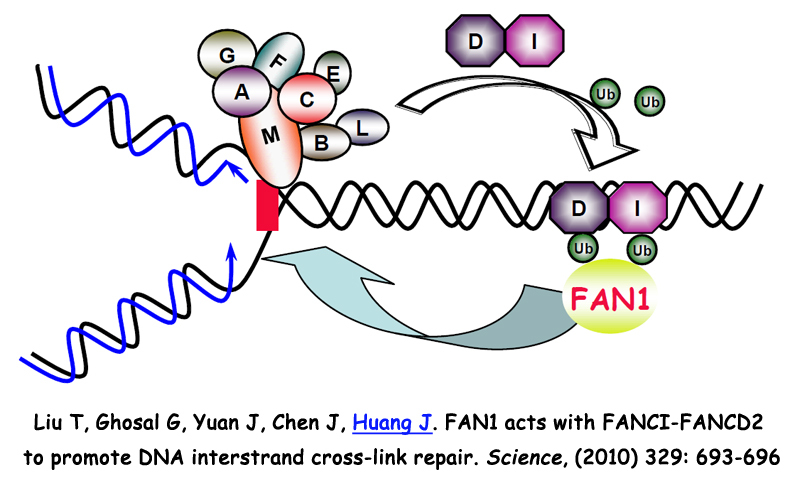
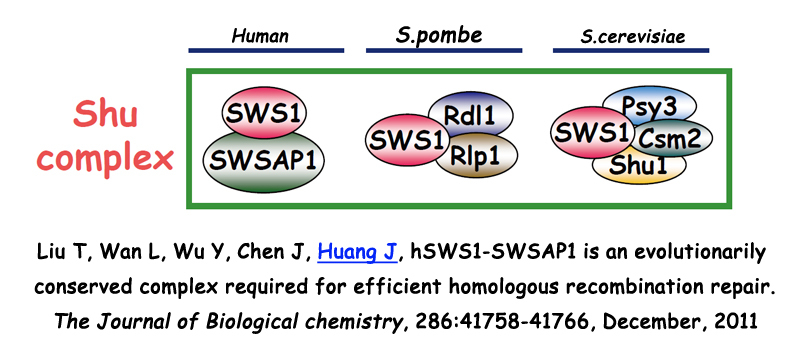
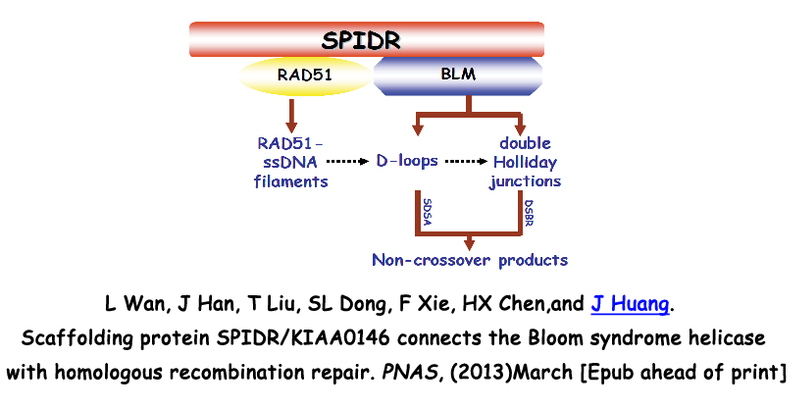
3. SPIDR在布鲁姆综合症及同源重组修复信号通路中的分子机制研究
4. The Human SRCAP Chromatin Remodeling Complex Promotes DNA-End Resection

同源重组修复(homologous recombination)是一种十分精确的DNA损伤修复方式,它主要发生在细胞周期的S和G2期。同源重组修复缺陷会导致基因组不稳定从而引起多种疾病包括肿瘤的发生。近年来的研究表明,当DNA发生双链断裂后,由于染色质的高度紧密折叠使得参与同源重组修复起始的关键蛋白不能有效的被招募到损伤的DNA位点,所以同源重组修复首先必须克服染色质结构的紧密性。然而,哪个(些)染色质修饰复合物特异参与改变损伤后断裂的双链DNA结构从而有效招募参与同源重组修复蛋白到DNA损伤位点来促进同源重组修复起始还不清楚。
SRCAP是一个ATP依赖的染色质重塑酶,SRCAP基因突变会导致Floating-Harbor syndrome疾病的发生(该疾病主要表现为语言障碍、一定程度的脸部畸形的较为罕见的遗传性综合征)。黄俊课题组研究发现,当DNA发生双链断裂时,SRCAP能够被迅速地招募到DNA损伤位点,并通过ATP酶依赖的方式招募重要损伤修复蛋白CtIP进而促进同源重组修复。 该研究不仅揭示了ATP依赖的染色质重塑酶在促进同源重组修复和维持基因组稳定过程中的重要作用,还将为今后对Floating-Harbor syndrome疾病的药物治疗提供分子学依据。
原文链接:http://www.cell.com/current-biology/abstract/S0960-9822%2814%2900982-8
5. DNA双链断裂损伤被细胞识别并修复的分子机制
AUNIP/C1orf135 directs DNA double-strand breaks towards the homologous recombination repair pathway
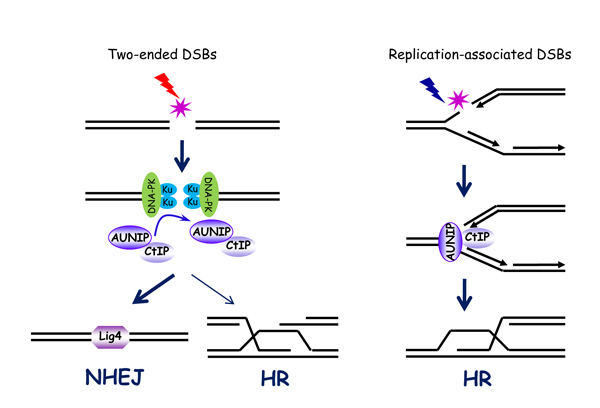
论文阐明了AUNIP/C1orf135蛋白在识别并区分不同类型的DNA双链断裂损伤(double-strand breaks, DSBs)并选择正确的DSBs修复途径中的重要功能及作用机制。DSBs是最具威胁的DNA损伤类型之一,如果不能及时修复或发生错误修复,则会导致基因突变、基因组不稳定以及肿瘤等重大疾病的发生。DSBs根据它末端的性质可以分为两种类型:双末端DSBs (Two-ended DSBs)和复制相关的单末端DSBs (Replication-associated one-ended DSBs)。DSBs主要通过非同源末端连接(non-homologous end-joining,NHEJ)和同源重组(homologous recombination,HR)这两种修复途径完成修复。研究表明,Two-ended DSBs主要通过NHEJ完成修复;而Replication-associated one-ended DSBs则只能通过HR完成修复。如果Replication-associated one-ended DSBs通过NHEJ完成修复,则会导致不同染色体之间的连接,进而引起translocation的发生以及基因组不稳定。然而,细胞如何识别并区分这两种不同类型的DSBs从而选择正确的DSBs修复途径还很不清楚。
黄俊实验室的研究发现AUNIP蛋白是一个重要的DSBs的识别因子。一方面,AUNIP通过优先结合Replication-associated one-ended DSBs从而区分Two-ended DSBs和Replication-associated one-ended DSBs。另一方面,AUNIP通过与HR关键起始蛋白CtIP直接相互作用从而优先招募CtIP蛋白到Replication-associated one-ended DSBs上,使得Replication-associated one-ended DSBs只能通过HR完成修复。与此同时,由于AUNIP蛋白结合Two-ended DSBs能力较弱,导致CtIP蛋白不能够被有效的招募到Two-ended DSBs位点,进而使得Two-ended DSBs主要通过NHEJ完成修复。该研究不仅阐明了DSBs修复途径的正确选择在维持基因组稳定以及抑制肿瘤发生过程中的重要作用,还将为今后对肿瘤的药物治疗提供新的分子靶标及理论支持。
原文链接:https://www.nature.com/articles/s41467-017-01151-w
6. 乳腺癌易感基因BRCA2维持基因组稳定性的新机制
BRCA2 antagonizes classical and alternative nonhomologous end-joining to prevent gross genomic instability
BRCA2是目前已知的三个乳腺癌易感基因之一,它的突变造成了约50%的家族遗传性乳腺癌及卵巢癌的发生。BRCA2突变的细胞对诱导DNA损伤的药物十分敏感,并表现出大量的基因组不稳定现象(gross genomic instability)。目前认为BRCA2维持基因组稳定性主要归功于其招募重组酶RAD51到DNA损伤位点,促进同源重组修复(homologous recombination,HR)。
在该研究中,黄俊实验室首次发现了BRCA2不依赖于RAD51招募的抑制基因组不稳定性的新功能――拮抗53BP1-RIF1-Artemis介导的经典的非同源末端连接修复(classical nonhomologous end-joining, c-NHEJ)和选择性非同源末端连接修复(alternative nonhomologous end-joining,alt-NHEJ)。BRCA2通过拮抗这两条易错修复信号通路,抑制基因组缺失(deletion)和移位(translocation)的发生,进而维持基因组的稳定性。该研究不仅首次阐明了乳腺癌易感基因BRCA2不同于以往的维持基因组稳定性的新机制,还将为BRCA2突变的肿瘤患者提供新的治疗思路。
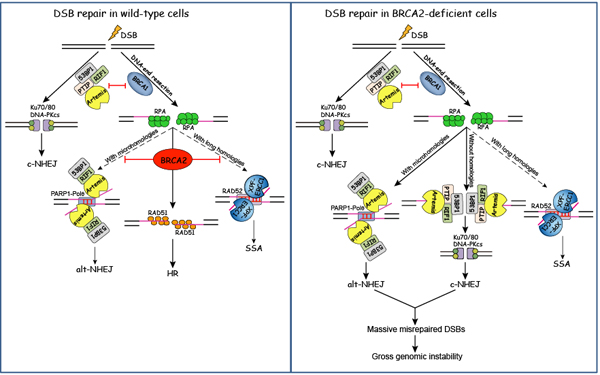
原文链接:https://www.nature.com/articles/s41467-017-01759-y
7. DNA复制过程中“鸡爪结构”形成的新模型
The ZATT-TOP2A-PICH axis drives extensive replication fork reversal to promote genome stability
该研究揭示了复制叉翻转(Fork reversal)过程中通过ZATT-TOP2A-PICH轴调控复制叉进一步翻转的分子机制,提出了复制叉翻转的两步调控模型。
DNA的精确复制对于维持基因组稳定性至关重要。然而复制叉时常会遭受来自细胞内外的复制压力而停滞,如果无法及时重新起始,将造成复制叉崩塌,影响基因组稳定性甚至导致细胞死亡。1976年Higgins N. Patrick等人在研究复制相关的损伤修复时,在哺乳动物细胞中观察到了一种Holliday Junction的结构。他们猜测该结构形成的原因是复制叉停滞后,两条新合成的DNA子链与亲代DNA链解开后发生退火而翻转,进而将正常的复制叉结构重塑成Holliday Junction结构(图一),该过程也被称为复制叉翻转。由于Holliday Junction结构的形状与鸡爪相似,生物化学教科书中也通常将其称为“鸡爪结构 (chicken foot)”。受检测技术的限制,直到2002年José M. Sogo等人才在检验点缺陷的酵母细胞中观察到“鸡爪结构”,“鸡爪结构”也因此被认为是复制失败的副产物,其生理意义一直存在争议。近年来研究表明,在高等真核生物细胞中,复制叉翻转是由PARP1介导的应对复制压力的关键调控机制,酵母中由于缺乏PARP基因,因而在正常生理条件下极少能够观察到“鸡爪结构”的存在。
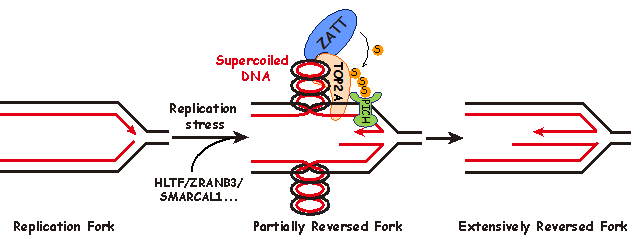
该研究首次提出了“鸡爪结构”是通过两步级联反应而形成的新模型(图一)。第一步,在复制叉遭遇复制压力时,复制叉发生停滞,由转位酶HLTF、ZRANB3、SMARCAL1等蛋白催化复制叉的初始翻转,同时在复制叉后方新合成的DNA双链上产生拓扑张力;第二步,拓扑异构酶TOP2A释放拓扑张力,并通过SUMO化修饰招募转位酶PICH促进复制叉的深度翻转。进一步的功能研究表明,复制叉的深度翻转对于维持基因组稳定性至关重要。
原文链接:https://doi.org/10.1016/j.molcel.2020.11.007
8. 细胞精确调控同源重组修复的分子机制
ATM controls the extent of DNA end resection by eliciting sequential posttranslational modifications of CtIP
共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)编码的激酶ATM在DNA双链断裂损伤修复中起着重要的作用。ATM基因突变的共济失调毛细血管扩张症(ataxia-telangiectasia,AT)患者对造成DNA双链断裂的辐射高度敏感且易患肿瘤。同源重组修复(homologous recombination)是一种精确的DNA双链断裂损伤修复方式,同源重组修复缺陷会导致基因组不稳定,引起包括肿瘤在内的多种疾病的发生,例如同源重组修复的关键基因CtIP的突变会引起Seckel综合征(Seckel syndrome)。
虽然同源重组修复在基因组稳定性维持过程中起着十分重要的作用,但是细胞如何精确调控同源重组修复还很不清楚。黄俊课题组的研究首次发现DNA遭受双链断裂损伤后,激酶ATM介导CtIP的磷酸化修饰促使SUMO化修饰连接酶PIAS4识别CtIP,并对磷酸化的CtIP进行SUMO化修饰。SUMO化修饰的CtIP进一步被SUMO靶向的泛素连接酶(SUMO-targeted ubiquitin ligase,STUBL)RNF4识别进而被泛素化修饰及降解。激酶ATM对CtIP的磷酸化修饰调控了磷酸化的CtIP的SUMO化修饰及后续的泛素化修饰,有效控制了DNA损伤位点CtIP的蛋白水平,精确地调节了同源重组修复。该研究不仅阐明了细胞精确调控同源重组修复的分子机制,还将为AT综合征和Seckel综合征的致病机理以及治疗提供新的思路。

原文链接:https://doi.org/10.1073/pnas.2022600118
9.BRCA1-BARD1复合物识别DNA损伤位点的分子结构基础
Structural insight into BRCA1-BARD1 complex recruitment to damaged chromatin
论文揭示了乳腺癌易感基因产物BRCA1-BARD1异源二聚体被招募到DNA双链断裂损伤(DNA double-strand breaks,DSBs)处的分子与结构基础。基因组DNA每天都面临各种类型的损伤,DSBs是最为严重的损伤类型之一,单个裸露的DSB即可诱发细胞凋亡。DSB主要通过非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous recombination,HR)两种方式来进行修复。同源重组修复发生在S和G2期,受损的DNA以姐妹染色单体上的同源序列为模板进行修复。因此,同源重组修复是十分精确的修复方式,一旦同源重组修复发生缺陷将导致基因组不稳定,引起包括肿瘤在内的多种疾病的发生。乳腺癌易感基因BRCA1编码的蛋白促进DSB修复选择精确的同源重组修复方式,对于维持基因组稳定性至关重要。携带BRCA1种系突变的个体一生累计乳腺癌发病风险高达80%,卵巢癌发病风险高达40%-60%。
BRCA1蛋白如何被招募到DNA损伤位点促进同源重组修复的机制还不明确。周政实验室和黄俊实验室合作通过结构生物学、生物化学和细胞生物学等手段阐明了BRCA1-BARD1异源二聚体通过BARD1结合核小体并识别组蛋白标记而被招募到DSB位点,进而促进同源重组修复(如图)。有意思的是,本研究发现BARD1通过识别泛素K63-E64位点,而非普遍存在的I44与I36位点与泛素结合,从而揭示了一种新的泛素识别模式。BARD1同时识别了核小体上DNA损伤诱导的H2AK15ub标记和新生核小体上未被甲基化修饰的H4K20me0标记。BARD1-泛素化核小体的结合是BRCA1-BARD1复合物在S/G2期被招募到DSB位点的基础。破坏BARD1-泛素化核小体的相互作用严重影响了BRCA1-BARD1复合物在DSB位点的招募,致使同源重组修复效率下降,从而导致细胞对同源重组修复缺陷的肿瘤靶向治疗药物-聚腺苷酸二磷酸核糖聚合酶抑制剂(PARPi)非常敏感。我们的进一步研究发现BARD1与泛素化核小体的结合界面上存在多个癌症相关的突变,提示相关的BARD1突变破坏其识别泛素化核小体的能力,导致同源重组修复缺陷,从而导致癌症的发生。

本研究解析了BRCA1-BARD1复合物被招募到DNA损伤位点的分子和结构基础,诠释了相关BARD1突变的致病机理,同时为相应的癌症治疗提供了新的思路。
原文链接:https://doi.org/10.1016/j.molcel.2021.05.010


