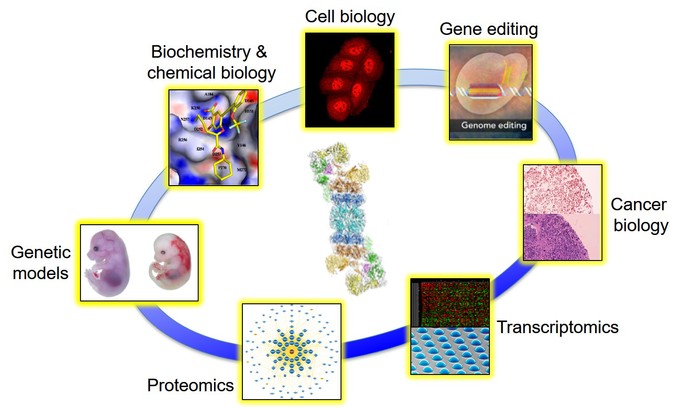
研究方向:
我们关注各种化学修饰对蛋白质功能、定位和稳定性的影响,目前实验室主要聚焦于26S蛋白酶体(the 26S proteasome) 在各种生理、病理过程中的调控机制及其在发育、疾病和衰老中的意义。
 蛋白质的合成与降解共同调节细胞中的蛋白稳态(proteostasis) ——这是所有生命的基础。在这一过程中,蛋白质的降解与其合成有着同等重要的意义。从酵母到人,所有真核生物细胞中绝大部分蛋白质的降解都依赖于泛素-蛋白酶体系统(the Ubiquitin-Proteasome System, UPS)。作为这一系统的核心,蛋白酶体对于几乎所有生物学过程都不可或缺——从细胞分裂到DNA修复,从基因表达到细胞垃圾的清除,从信号转导到细胞凋亡。可以说,任何生命活动只要有蛋白质参与,基本都依赖于蛋白酶体发挥功能。
蛋白质的合成与降解共同调节细胞中的蛋白稳态(proteostasis) ——这是所有生命的基础。在这一过程中,蛋白质的降解与其合成有着同等重要的意义。从酵母到人,所有真核生物细胞中绝大部分蛋白质的降解都依赖于泛素-蛋白酶体系统(the Ubiquitin-Proteasome System, UPS)。作为这一系统的核心,蛋白酶体对于几乎所有生物学过程都不可或缺——从细胞分裂到DNA修复,从基因表达到细胞垃圾的清除,从信号转导到细胞凋亡。可以说,任何生命活动只要有蛋白质参与,基本都依赖于蛋白酶体发挥功能。

尽管其重要性毋庸置疑,但长期以来蛋白酶体也仅被当作是一成不变、有求必应的“细胞垃圾桶”。受这种普遍观点的影响,人们经常忽略这样一个重要问题:蛋白酶体如此关键,其自身是如何被调控的?事实上,越来越多的证据表明,蛋白酶体在细胞增殖、干细胞分化、信号转导、免疫应答、神经传导、应激反应等多种生理过程中会发生变化;而蛋白酶体功能异常则与癌症、自身炎症疾病、神经退行性疾病、心脑血管疾病等密切相关,并且是细胞及个体衰老的重要标志。但整体而言,目前人们对蛋白酶体的调控机制及其生物学功能的了解还只是冰山一角。
作为国内为数不多的专注于蛋白酶体研究的实验室之一,我们一直以来通过多种先进技术手段和广泛合作对各种蛋白酶体调控机制进行深入探索(左图)。
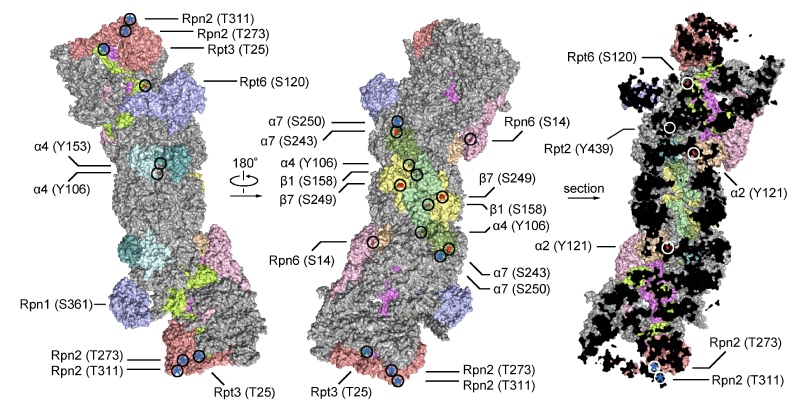
磷酸化是最常见的蛋白酶体修饰之一,也是蛋白酶体接入细胞信号转导网络的重要方式。我们在蛋白酶体磷酸化方面积累了丰富的研究经验。下图列举了一小部分具有已知或潜在生物学功能的蛋白酶体磷酸化位点。值得注意的是,人类26S蛋白酶体表面已知存在450个以上的磷酸化位点,而其中超过95%的位点还没有任何研究。
另一个普遍的误解是认为蛋白酶体只游荡于细胞质中。事实上蛋白酶体存在于细胞各处,并可以定位于多种膜结构(如下图所示)。蛋白酶体亚细胞定位的机制及“蛋白质区域化降解”的生物学功能也是我们的重要研究方向之一。

在过往的研究中,我们
· 发现了第一个特异性调控蛋白酶体的丝/苏氨酸磷酸酶
· 发现了第一个调控蛋白酶体的酪氨酸磷酸酶
· 首次证明蛋白酶体自身在细胞周期中受到动态磷酸化的调控并反馈于细胞周期
· 首次利用遗传密码拓展技术从分子层面阐明了磷酸化调控蛋白酶体组装的生化机制
· 首次揭示膜定位蛋白酶体受到特殊调控并负责细胞内的区域化蛋白质降解
· 首次制备了多种蛋白酶体修饰特异性抗体
· 首次繁育了多种用于研究蛋白酶体调控的基因编辑小鼠
.
.
.
我们基于细胞生物学和生物化学的成熟手段,整合蛋白组学、基因组学、生物影像学、结构生物学、化学生物学、基因编辑、癌症生物学、神经生物学、动物行为学等多种学科的技术,全方位深入研究蛋白酶体调控与蛋白质降解这一基本生物学问题。同时希望我们在基础科学研究中的发现能转化为具有临床意义和商业价值的技术和产品。